TERAPI
HERBAL ANTIINFLAMASI
Pendahuluan
Inflamasi adalah respon biologis kompleks dari jaringan vaskuler atas
adanya bahaya, seperti pathogen, kerusakkan sel, atau iritasi. Ini adalah usaha
perlindungan diri organisme untuk menghilangkan rangsangan penyebab luka dan
inisiasi proses penyembuhan jaringan. Jika inflamasi tidak ada maka luka dan
infeksi tidak akan sembuh dan akan menggalami kerusakkan yang lebih parah.
Inflamsi yang tidak terkontrol juga dapat menyebabkan penyakit, seperti demam,
atherosclerosis, dan reumathoid arthritis. (Gard, 2001) Inflamasi dapat
dibedakan atas inflamasi akut dan kronis. Inflamasi akut adalah respon awal
tubuh oleh benda berbahaya dan meningkat dengan meningkatnya pergerakkan plasma
dan leukosit dari darah ke jaringan luka. Reaksi biokimia berantai yang
mempropagasi dan pematangan respon imun, termasuk system vaskuler, system imun,
dan berbagai sel yang ada pada jaringan luka. Inflamasi kronis adalah atau
inlamasi yang berpanjangan memicu peningkatan pergantian tipe sel yang ada pada
tempat inflamasi dan dicirikan dengan kerusakkan dan penutupan jaringan dari
proses inflamasi. (Gard, 2001)

Manifestasi
klinis inflamasi
Fenomena
inflamasi meliputi kerusakan mikrovaskular, meningkatnya permeabilitas kapiler
dan migrasi leukosit ke jaringan radang. Gejala umum proses inflamasi yang
sudah dikenal yaitu, kolor, rubor,tumor, dolor, dan function laesa.
Selama proses inflamasi terjadi banyak mediator kimia yang dilepaskan secara
local antara lain histamine, 5-hidroksitriptamin (5-HT), factor kemotatik,
bradikinin, leukotrien, dan PG.
Dengan
migrasi sel fagosit kedaerah inflamasi terjadi lisis membrane lisozim dan
lepasnya enzim pemecah. PG hanya berperan pada nyeri yang terkait dengan
kerusakan jaringan atau inflamasi. PG menimbulkan keadaan hiperalgesia,
kemudian mediator kimia seperti bradikinin dan histamine merangsangnya dan
menimbulkan nyeri yang nyata. (Gard, 2001)
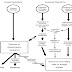
Gambar
ini memperlihatkan ada tiga proses yang timbul akibat respon tubuh. Pertama
adalah reaksi bawaan. Kerusakkan seluler mennyebabkan pelepasan berbagai
mediator yang dihasilkan dari dalam plasma atau dalam sel. Beberapa diantaranya
adalah histamine, prostaglandin, leukotrien. Dalam respon medioator adalah
vasodilatasi local, yang meningkatkan aliran darah dan permebialitas vaskuler,
hal itulah yang menyebabkan terjadinya kemerahan, panas dan bengkak yang
terlihat saat inflamasi. Eksudat dari kapiler tidak hanya mengandung mediator,
tapi juga mengandung fragment dari protein asing atau organisme penginfeksi
yang akan dibawa ke jaringan limpa untuk menstimulasi pembentukkan antibody.
Benda darah seperti neutrofil dan monosit juga bergerak keluar dari pembuluh
darah, ditarik oleh chemotaxin yang juga diproduksi akibat infeksi organism.
Beberapa mediator inflamasi juga berperan pada ujung syaraf local untuk
menstimulasi rasa nyeri.
Mekanisme
pertahanan tubuh lainnya adalah acquired, proses imun spesifik,
dinamakan demikian karena memproduksi sel baru dan spesifik untuk infeksi
organism atau protein asing; meliputi pengenalan protein asing (antigen) oleh
limfosit. Dalam kasus system imun seluler, limfosit T adalah sel T sitotoksik,
sehingga dapat menyerang sel penginfeksi, atau sel T helper yang mensekresikan
sitokin ( yang juga berpotensi pembentukkan antibody oleh limfosit B atau
mengaktivkan makrofag. Limfosit B memproduksi antibody yang berinteraksi dengan
antigen untuk mengaktifkan system komplemen, yang hasilnya pencernaan atai
inaktivasi benda asing. Tipe antibody spesifik, IgE, menyebabkan pelepasan
mediator inflamasi dari sel mast.
Antiinflamasi
Mekanisme homeostatik antiinflamasi merupakan kebalikan dari proses ini karena
zat penginfeksi dibersihkan oleh sistem imun bawaan dan adaptive.
Antiinflamasi
dibedakan atas dua yakni:
1. Antiinflamasi steroid
2.
Antiinflamasi nonsteroid
A. Antiinflamasi steroid Mekanisme kerja antiinflamasi steroid (Thruk,
2005).
1. Glukokortikoid membentuk komplek dengan reseptor glukokortikoid,
kemudian dibawa ke nukleus dan berikantan dengan glukokortikoid respone element
di DNA. Dengan melibatkan proteinkoaktivator dan korepresor yang akan
memodifikasi struktur kromatin, kemudian memfasilitasi atau menhambat perakitan
dari mesin transkripsi basal dan inisiasi transkripsi oleh RNA pol II.
2. Regulasi_glukokortikoid-GRE yang dipengaruhi oleh interaksi glukokortikoid-GRE
dengan faktor transkripsi lain, seperti NFkB.
3. glukokortikoid mensignal berasosiaasi reseptor membran dan second
messenger. Ikatan reseptor dengan kortisol memiliki afinitas yang tinggi
sehingga menyebabkan pelepasan molekul HSP dari reseptor.
Didalam sitoplasma, kompleks tersebut akan
menghambat produksi prostaglandin melalui 3 mekanisme :
1.
induksi da aktivasi annexin
2.
induksi MSPK phospatase
3.
penekanan transkripsi siklooksigenase
B. Antiinflamasi nonsteroid
Biasanya obat ini memiliki tiga efek utama
yakni antiinflamasi, analgetik, dan antipiretik. Mekanisme antiinflamasi non
steroid adalah menghambat enzim siklooksigenase COX dan juga menghambat
sintesis prostaglandin. AINS banyak digunakan pada pasien pediatric. Obat ini
merupakan bahan aktif yang secara farmakologi tidak homogen dan terutama
bekerja menghambat produksi prostaglandin serta digunakan untuk perawatan nyeri
akut dan kronik. Obat ini mempunyai sifat mampu mengurangi nyeri, demam dengan inflamasi,
dan yang disertai dengan gangguan inflamasi nyeri lainnya.1 Dalam prakteknya dokter
selalu menanggulangi keluhan rasa sakit atau nyeri pada pasien dengan pemberian
obatobatan analgetika sederhana, dan pada kenyataannya belum mampu mengontrol
rasa sakit akibat inflamasi.
AINS merupakan sediaan yang paling luas
peresepannya terutama pada kasus-kasus nyeri inflamasi karena efeknya yang kuat
dalam mengatasi nyeri inflamasi tingkat ringan sampai sedang. Dalam peresepan AINS
hal yang terpenting adalah pertimbangan efek terapi dan efek samping yang
berhubungan dengan mekanisme kerja sediaan obat ini, terutama pemberian pada
anak. Dimana efek samping AINS dapat terjadi pada berbagai organ tubuh
terpenting seperti saluran cerna, jantung dan ginjal, sedangkan organ-organ
vital pada anak masih mengalami perkembangan menuju kesempurnaan.
Tentunya hal ini patutlah menjadi perhatian,
khususnya menyangkut pengetahuan farmakokinetik dan farmakologik obat atau
patofisiologi proses penyakit yang akan diterapi. Seiring dengan perkembangan
sediaan AINS, para ahli mengupayakan penyediaan obat ini dengan efek samping
yang seminimal mungkin, diantaranya merubah formulasi dan penemuan sediaan AINS
baru. Akan tetapi ternyata sediaan terkinipun tidak mampu memberikan solusi
yang terbaik sebab disatu sisi memberikan efek samping minimal terhadap suatu
organ tubuh tertentu, tetapi memberi efek samping yang lebih besar terhadap
organ tubuh lainnya. Untuk itu hal yang terbaik dilakukan adalah menghindari
peresepan yang tidak diperlukan, sebab resikonya akan lebih besar jika
kontraindikasi AINS tidak diindahkan atau tidak menjadi perhatian yang utama, khususnya
pemberian pada anak.
Mekanisme dan sifat dasar ains, Obat analgesik
anti inflamasi non steroid merupakan suatu kelompok sediaan dengan struktur kimia
yang sangat heterogen, dimana efek samping dan efek terapinya berhubungan dengan
kesamaan mekanisme kerja sediaan ini pada enzim cyclooxygenase (COX). Kemajuan penelitian
dalam dasawarsa terakhir memberikan penjelasan mengapa kelompok yang heterogen tersebut
memiliki kesamaan efek terapi dan efek samping, ternyata hal ini terjadi
berdasarkan atas penghambatan biosintesis prostaglandin (PG). Mekanisme kerja
yang berhubungan dengan biosintesis PG ini mulai dilaporkan pada tahun 1971
oleh Vane dan kawan-kawan yang memperlihatkan secara invitro bahwa dosis rendah
aspirin dan indometason menghambat produksi enzimatik PG. Dimana juga telah
dibuktikan bahwa jika sel mengalami kerusakan maka PG akan dilepas.Namun
demikian obat AINS secara umum tidak menghambat biosintesis leukotrin,yang
diketahui turut berperan dalam inflamasi. AINS menghambat enzim cyclooxygenase
(COX) sehingga konversi asam arakidonat menjadi PGG2 terganggu. Setiap obat
menghambat cyclooxysigenase dengan cara yang berbeda.
AINS dikelompokkan berdasarkan struktur
kimia,tingkat keasaman dan ketersediaan awalnya. Dan sekarang yang popoler
dikelompokkan berdasarkan selektifitas hambatannya pada penemuan dua bentuk
enzim constitutive cyclooxygenase-1 (COX-1) dan inducible cycloocygenase-2
(COX-2).COX-1 selalu ada diberbagai jaringan tubuh dan berfungsi dalam
mempertahankan fisiologi tubuh seperti produksi mukus di lambung tetapi sebaliknya
,COX-2 merupakan enzim indusibel yang umumnya tidak terpantau di kebanyakan jaringan,
tapi akan meningkat pada keadaan inflamasi atau patologik. AINS yang bekerja sebagai
penyekat COX akan berikatan pada bagian aktif enzim,pada COX-1 dan atau COX - 2,
sehingga enzim ini menjadi tidak berfungsi dan tidak mampu merubah asam arakidonat
menjadi mediator inflamasi prostaglandin.3,4 AINS yang termasuk dalam tidak
selektif menghambat sekaligus COX-1 dan COX-2 adalah ibuprofen,indometasin dan
naproxen.
Asetosal dan ketorokal termasuk sangat selektif
menghambat menghambat COX-1. Piroxicam lebih selektif menyekat COX-1, sedangkan
yang termasuk selektif menyekat COX-2 antara lain Celecoxib dan rofecoxib
sangat selektif menghambat COX-2.5 Penggunaan ains pada berbagai penyebab AINS
efektif mengurangi nyeri dengan intensitas ringan sampai sedang seperti pada nyeri
dental.untuk nyeri yang lebih berat diperlukan analgesik yang tidak menimbulkan
ketergantungan,misalnya tramadol. AINS memiliki efek analgesik pada nyeri yang
berasal dari integument bukan yang berasal dari viscera, seperti sakit
kepala,myalgia dan abralgia.6 Setiap sediaan AINS memberikan efek anti-inflamasi
yang sepadan. Colberg dkk pada tahun 1996 mengemukakan bahwa antara diklofenak
dengan meloksikam tidak ada perbedaannya dalam hal khasiat analgetik
antiinflamasi, baik diberikan peroral ataupun dengan injeksi. Studi banding
yang dilakukan memperlihatkan nyeri, panas dan inflamasi pada pemberian
nimesulide 200 mg/hari peroral atau 400 mg/hari per rektal sama atau lebih baik
dibanding seaperase ( 15 mg), flurbiprofen (300 mg), deklofenak (150 mg),
naproxen (1000 mg), fiprazon, piroksikam, asam mefenamat pada penderita dengan
inflamasi telinga, hidung, tenggorokan nyeri kanker,gangguan ginekologi, kelainan
urogenital, cidera musculoskeletal akut, tromboflebitis, nyeri punggung
belakang, tendonitis dan penyakit odonstomatologi serta pasca tindakan bedah.
7,8 Pemilihan ains pada anak AINS banyak digunakan untuk pasien pediatrik.
Satu-satunya obat dari kelompok indol yang
diizinkan oleh FDA adalah tolmetin atau naproksen sebagai analgesik pediatrik. Indometason
adalah salah satu penghambat prostaglandin yang paling kuat, tetapi penggunaan
pada pasien anak hanya terbatas pada terapi duktus arteriosus. Akan tetapi indometason
bermanfaat dalam mengurangi kebutuhan akan analgesia narkotik pasca bedah pada
anak-anak,sayangnya indometason mempunyai sifat toksik pada ginjal. Pemilihan
obat AINS pada anak yang sudah diuji penggunaanya pada anak, yaitu aspirin,naproksen
atau tolmetin, kecuali untuk pemberian aspirin pada anak kemungkinan dapat
terjadi Reye’s Syndrome. Akan tetapi untuk menurunkan panas atau demam pada
anak aspirin dapat diganti dengan asetaminofen.
Yang menjadi perhatian adalah nimesulid tidak dianjurkan
untuk anak dibawah 12 tahun. Sebagai antipiretik-analgesik untuk anak , parasetamol
juga dianggap suatu pilihan yang tepat, akan tetapi tetap harus mempertimbang kan
kemungkinan efek samping terhadap kondisi tubuh anak. Belakangan ini ibufrofen turut
menjadi pilihan dan terbukti aman untuk anak-anak.1,2,9 Pertimbangan pemilihan
obat AINS pada anak ini tentunya didasarkan pada hasil penelitian para ahli
yang telah diuji keamanannya. Hal yang harus menjadi perhatian penting adalah
pemberian obat secara rasional dan pemahaman dasar gambaran farmakokinetik dan
farmakodinamik obat. Farmakokinetik merupakan aspek farmakologi yang mencakup
nasib obat dalam tubuh, meliputi absorbsi obat, distribusi, metabolisme, dan
ekskresi. Dimana keasaman lambung yang lebih rendah pada anak dibanding orang
dewasa dapat mempengaruhi absorbsi obat – obat tertentu, demikian pula dengan
waktu pengosongan lambung yang lebih lambat pada anak juga dapat mempengaruhi
kecepatan absorbsi obat.
Pada proses metabolisme obat, cenderung lebih
lambat pada neonatus dan meningkat secara progresif selama beberapa bulan
kehidupan, dan akan melewati kecepatan orang dewasa pada beberapa tahun
kehidupan. Hal ini berpengaruh pada waktu paruh obat yang dapat lebih singkat
akibat meningkatnya laju metabolisme. Untuk farmakodinamik menyangkut mekanisme
kerja agen-agen farmakologik, dimana pada individu yang belum matang dapat
berubah antara lain karena pengurangan atau peningkatan jumlah reseptor tempat
bekerjanya obat ( hormone, neurotransmitter) dan ketidakmatangan metabolik
struktur dan fungsional dari reseptor.13,14,16 Efek samping ains Obat-obat AINS
yang termasuk dalam penghambat selektif COX-1 seperti ketoprofen, piroxicam,
tenoxicam, indometasin,dan aspirin, memberikan efek analgesik yang cukup baik dan
nyata akan tetapi sayangnya memberi resiko toksisitas saluran cerna yang besar,
dapat mengakibatkan gangguan fungsi ginjal dan perdarahan pasca bedah. Oleh
karena itu penggunaan obat ini dihindari pada pasien dengan riwayat gastritis
atau ulkus peptikum dan hemofili, juga kita harus hati-hati pada pasien
penerima kortikosteroid atau obat-obatan antikoagulan. Nefritis interstisial,
gagal ginjal, dan sindrom nefrotik telah dilaporkan terjadi pada anak-anak
setelah pemberian AINS dalam jangka panjang . Ibufrofen, naproksen dan indometason
diduga dapat memicu reaksi hipersensitivitas, terutama ruam kulit dan bronkospasme.2,3,4
Hal yang cukup membantu dalam pemberian AINS adalah adanya sediaan penghambat
selektif COX-2 yang dikembangkan dan digunakan untuk mengurangi toksisitas pada
saluran cerna.
Celecoxib dan refecoxib yang secara spesifik menghambat
COX- 2 menunjukkan efek samping yang minimal pada saluran cerna dibandingkan
diklofenak, naproxen dan ibufrofen. Akan tetapi efek ini bermakna hanya pada
penggunaan jangka pendek selama kurang dari enam bulan. Pada penggunaan jangka panjang
panjang diklofenak masih lebih aman dibanding celecoxib. Namun sayangnya dari segi
kajian farmakologi molekuler diketahui bahwa COX-2 sangat dibutuhkan dalam menjaga
kesehatan jantung. Pada penelitian Shinmura dkk disimpulkan bahwa COX -2 adalah
cardioprotective protein, sehingga jika aktifitas COX-2 dihambat akan berakibat
semakin meningkatnya kejadian kardiovaskuler.
Selain itu hambatan terhadap aktivitas COX akan
menurunkan produksi vasodilator prostaglandin sehingga tidak ada mediator yang
mampu mengatasi efek vasokonstriktor katekolamin, dimana akibatnya akan
meningkatkan tekanan darah penderita.3,4,10
Bandotan
(Ageratum conyzoides)
1. Deskripsi
Tanaman
Ø
Taksonomi
v
Kingdom : Plantae
v
Sub
kingdom : Tracheobionta
v Divisi : Magnoliophyta
v Sub divisi : Angiospermae
v Super divisi : Spermatophyta
v Kelas : Magnoliopsida
v Sub kelas : Asteridae
v Ordo : Asterales
v Famili : Asteraceae
v
Genus : Ageratum
L.
v Spesies : Ageratum conyzoides L.(1)
Ø
Nama Latin
Ageratum conyzoides Linne.
Ø
Sinonim
Cacalia
mentrasto Vell., Ageratum album Stend., A. caeruleum Hort. ex. Poir., A. coeruleum Desf., A. ciliare Lour. (non Linn), A.
cordifolium Roxb., A. hirsutum
Lam., A. humile Salisb., A. latifolium Car., A. maritimum H.B.K., A.
mexicanum Sims., A. obtusifolium
Lam., A. odoratum Vilm., Eupatorium conyzoides, Carelia conyzoides.
Ø
Nama Simplisia
Agerati Herba
(herba bandotan) dan Agerati Radix (akar bandotan).
Ø
Nama Daerah
v Sumatera
: bandotan, daun tombak, siangit, tombak jantan, siangik kahwa, rumput tahi
ayam.
v Jawa&
Madura : bandotan, babadotan, babandotan, b. leutik, b. beureum, b. hejo, jukut
bau, ki bau, berokan (Sunda), wedusan, dus wedusan, dus bedusan, tempuyak
(Madura).
v Sulawesi
: dawet, lawet, rukut manooe, rukut weru, sopi.
Ø
Nama Asing
v
Catinga
de bode, catinga de barrao, erva de sao joao, maria preta, mentrasto, erva de
sao jose, picao roxo, erva de santia-lucia, camara-opela, agerato, camara
apeba, camara iapo, camara jape, erva de santa maria, macela de sao joao,
macela francesa, matruco (Brazil)
v
Pokasunga,
Odemadanga (India), hierba dulce (Meksiko),botobotekoro (Fiji), unchunti
(Indo-Fijian), Sheng hong ji (C), bulak manok (Tag.), ajganda, sahadevi (IP),
billy goat weed, white weed, bastard agrimony (I), celestine, eupatoire bleue.(2)
2. Deskripsi
Simplisia
ü Bandotan tergolong ke dalam tumbuhan terna semusim, berbau
khas seperti bau kambing, tumbuh
tegak atau bagian bawahnya berbaring, tingginya sekitar 30-90 cm, dan
bercabang.
ü Batang bulat berambut panjang, jika menyentuh tanah akan
mengeluarkan akar.
ü Daunbertangkai, letaknya saling berhadapan dan bersilang (compositae), helaian daunbulat telur
dengan pangkal membulat dan ujung runcing, tepi bergerigi, panjang 1-10 cm,
lebar 0,5-6 cm, kedua permukaan daun berambut panjang dengan kelenjaryang
terletak di permukaan bawah daun, warnanya hijau.
ü Bunga majemukberkumpul 3 atau lebih, berbentuk malai rata yang
keluar dari ujung tangkai, warnanya putih. Panjang bonggol bunga 6-8 mmberisi 60–70
individu bunga. Di ujung tangkai yang berambut, dengan 2–3 lingkaran daun
pembalut yang lonjong seperti sudip yang meruncing. Mahkota dengan tabung
sempit, putih atau ungu.
ü
Buahnya
berbentuk kecil seperti buah
kurung (achenium) bersegi-5, panjang 2 mm, berambut sisik 5 dan berwarna hitam.
Ø
Habitat
Bandotan
dapat diperbanyak dengan biji. Bandotan berasal dari Amerika tropis. Di
Indonesia, bandotan merupakan tumbuhan liar dan lebih dikenal sebagaitumbuhan
pengganggu (gulma) di kebun dan di ladang. Tumbuhan ini, dapatditemukan juga di
pekarangan rumah, tepi jalan, tanggul, dan sekitar saluran airpada ketinggian
2.100 m di atas permukaan laut (dpl). Jika daunnya telah layu danmembusuk,
tumbuhan ini akan mengeluarkan bau tidak enak. (2-4)
3. Kandungan
Kimia
Ø
Daun dan bunga Ageratum conyzoides mengandung
saponin, flavonoid, terpen dan polifenol, di samping itu daunnya juga
mengandung minyak atsiri. Kaempferol, glukosida dan rhamnosida, kuersitrin,
skutellarein, eupalestin, khromenes, stigmast-7-en-3-ol, betasitosterol,
stigmasterol, asam fumarat, asam kaffeat, alkaloida pirolizidin, oksigen
heterosiklis, derivat ageratokromen, kumarin, alkana.
Ø
Daun bandotan mengandung agekoniflavon, ageratokrromen;
3’,
4’-dihidro-6,6’,7,7’-tetrametoksi-2,2,2’,2’-tetrametil-3,4’-bi-2H-1-benzopiran;
3’, 4’, 5, 5’, 6, 8-heksamethoksiflavon; 8-hidroksi-3’, 4’, 5,
5’,6,7-heksamethoksiflavon, 6-metoksi-2,2-dimetil-2H-1-benzopiran;
7-metoksi-2,2-dimetil-2H-1-benzopiran.(2)
4. Efek
Farmakologi (Invitro / Invivo)
Ø Pemberian ekstrak etanol daun bandotan (Ageratum conyzoides) dengan dosis
berulang 1 g/kg BB secara oral pada tikus putih jantan memberikan efek
antiradang yang berarti. (5)
Ø Pemberian secara oral ekstrak daun
bandotan (Ageratum conyzoides) (dalam etanol 95%, dikentalkan) dengan dosis
berulang 0,5 g/kg BB yang disuspensikan dengan gom arab 5% memberikan inhibisi
radang sebesar 52,32% dengan efek yang bertahan sampai 360 menit pada pengujian
terhadap tikus putih jantan. (6)
Ø Pemberian secara oral ekstrak daun
bandotan (Ageratum conyzoides) (dalam etanol 95%, dikentalkan) dengan dosis
berulang 0,8 g/kg BB yang disuspensikan dengan gom arab 5% memberikan inhibisi
radang dapat mencapai lebih dari 85% pada pengujian terhadap tikus putih
jantan. (6)
Ø Ekstrak metanol
Herba Ageratum conyzoides L. memiliki aktivitas sitotoksik pada kultur
sel mieloma mencit. Hal ini didukung oleh sebuah penelitian menggunakan
teknologi HighThroughput Screening (HTS) dengan enzim DNA Topoisomerase
sebagai molekul target dan memberikan hasil bahwa ekstrak metanol herba tanaman
tersebut mampu menghambat enzim DNA Topoisomerase II. (7)(8)
Ø Subfraksi dari ekstrak etil asetat dari daun tanaman bandotan
memiliki aktivitas antibakteri berspektrum luas dengan nilai MIC tertinggi
terhadap bakteri S. aureus adalah 25 mg/ml dan 50 mg/ml terhadap E.
coli.(9)
Ø Infusa daun bandotandengan konsentrasi 0,5%; 1%;
2%; 3% dan 5% memiliki efek larvisida. LC50 infusa daun bandotan adalah 0, 444%. (10)
Ø Penggunaan konsentrasi menunjukan perbedaan yang signifikan
terhadap mortalitas larva nyamuk Aedes aegypti terlihat pada konsentrasi 0,8ml,
sampai konsentrasi 1,2ml sari organ daun dan akar mampu memberikan pengaruh
dengan konsentrasi yang paling tinggi yaitu 1,2ml sehingga konsentrasi 0,8%
sudah dapat digunakan untuk membunuh larva nyamuk Aedes aegypti.(11)
Ø
Efek
antipiretik Ageratum conyzoides
terhadap tikus demam kira-kira sepertiga kapasitas penurunan demam oleh
asetosal, Jasminum sambac tidak
memberikan efek antipiretik yang jelas dan Caesalpinia
pulcherrima memberikan kapasitas penurunan demam kira-kira setengah kali
dari asetosal. Pengaruh Ageratum
conyzoides, Caesalpinia pulcherrima
dan asetosal relatif kecil terhadap suhu tikus normal. Penurunan suhu normal
terbesar terjadi pada pemberian Jasminum
sambac dosis 2 g/kg bb yaitu sebesar 1,600C. Ageratum conyzoides, Jasminum
sambac dan Caesalpinia pulcherrima
tidak berpengaruh terhadap bobot tikus.(12)
Ø Ekstrak dan feaksi etil
asetat daun babadotan menunjukkan aktivitas antimikroba terhadap S. Aureus, P. Aeruginosa dan Candida albicans. Sedangkan ekstrak dan fraksi
etanol aktif terhadap C. Albicans, M.
Gypseum dan A. Niger. Sediaan
salep yang mengandung ekstrak etil asetat menunjukkan aktivitas antimikroba
yang lebih rendah dibandingkan dengan salep yang mengandung ekstrak etanol.
Hasil uji aktivitas antiinfeksi ekstrak pada punggung kelinci menunjukkan bahwa
daerah infeksi yang diberi sediaan salep sembuh dalam waktu 3-5 hari sedangkan
kelompok kontrol yang tidak diobati sembuh dalam waktu 9 hari. (13)
Ø Uji aktivitas insektisida ekstrak dan minyak dari tujuh belas tanaman obat dari Brazi ltelah di teliti menggunakan bioassay larvisida Aedes aegypti larvisida. Minyak dari Anacardium occidentalis, Copaiferalangsdorffii, Cara paguianensis, Cymbopogonwinterianus dan Ageratum conyzoides menunjukan aktivitas yang tinggi dengan masingg-masing nilai LC50dari14.5,4157, 98 dan148 µg/l. Penerapan potensi minyak kacang mete, oleh industri dengan produk yang nilai komersialnya rendah, dapat diusulkan dalam pengendali anvektorp enyakit demam berdarah dan kuning.
Ø Kulit batang Parkia big lobosaJacq. dan daun Ageratum conyzoidesLinn. Diteliti aktivitas anti bakteri dan sitotoksiknya. Semua fraksi daun A.conyzoides dan eterfraksi petroleumP. big lobosa adalah sitotoksik terhadap sel SK-MES 1, yang sampai batas tertentu dapat mendukung inklusi tradisional mereka untuk pengobatan kanker. Hasil keseluruhan terbukti bahwa ekstrak tanaman dapat menjadi sumber potensial obat anti bakteri dan anti kanker baru.
Ø Aktivitas in vitro etanol, petroleum eter, etilasetat, butanol, dan air ekstrak conyzoidesa. di saring dalam beberapa baris sel kanker menggunkan sulphorhodamineb ( SRB ) assay. ekstrak etil asetat menunjukan aktivitas sitotoksi tertinggi pada-549 dan P-388 sel kanker dengan nilai IC50dari0, 68 dan 0,0003mg/ml. A.conyzoides memiliki sifat anti kanker dan anti radikal.
Ø Ageratum conyzoidesmemiliki efek antikoksidial.
Ø Ekstrak air A. conyzoides yang dikombinasikan dengan
klorokuin dan artesunat berpotensi sebagai antimalaria dimana menginduksi
plasmodiasis pada tikus.
Ø Daun dan kandungan mineral A. conyzoides memiliki
efek hipoglikemik dan antihiperglikemik. (19)(20)
Ø Hydroalcohol di ekstrak dan Ageratumconyzoides L. pada dosis 250, 500 dan 1000mg/kg menunjukan aktivitas anti histamin mendalam menghambat clonidineyang di insuksi katalepsi pada Tikus.
Ø Penggunaan oral ekstrak etanol pada tingkat dosis 500 dan 750mg/kg secara signifikan melindungi lesi lambung sebesar 80. 59 dan 89, 33%
5. Indikasi
– Kontraindikasi
Ø Indikasi
Antiinflamasi,
antikanker, antimikrobial, antioksidan,
antipiretik, analgetik, antikoksidial, antimalaria, antidiabetes,
antiplasmodial, antikonvulsan, antihistamin, antiprotozoal, gastroprotektif,
menyembuhkan luka.(2-31)
Ø Kontraindikasi
Wanita hamil.
Ø Peringatan
Belum diketahui.
6. Data
Klinik
Belum
diketahui.
7. Reaksi
yang tidak dikehendaki
Tumbuhan ini
menyebabkan muntah muntah dan sakit perut yang teramat sangat. Ageratum conyzoides L. dapat juga menyebabkan kerusakan pada hati.(3)
8. Interaksi
Obat
Belum
diketahui.
9. Dosis,
Data Keamanan (LD50, Sub Kronik)
Ø
Penyiapan dan Dosis
Rebus 30 – 60 g herba bandotan
kering segar atau 15 – 30 gherba kering dalam tiga gelas air sampai tersisa
menjadi satu gelas. Selain direbus, herba segar dapat juga ditumbuk. Air
rebusan atau air perasannya diminum satu gelas sehari.(3)
§ Infus, sehari dua kali 1 gelas
§ Tingtur, 2-3 ml sehari dua kali
§ Serbuk (dalam kapsul), 1-2 g sehari dua
kali(2)
Untuk pemakaian luar, tumbuk herba segar sampai
halus. Selanjutnya, campurkan minyak sayur sedikit dan aduk sampai rata, lalu
bubuhkan pada luka yang masih baru, bisul, eksim, dan penyakit kulit lainnya
(seperti kusta/lepra).
Cara lain, giling herba kering menjadi serbuk, lalu
tiupkan ke kerongkongan penderita yang sakit tenggorokan. Selain itu, daun
segar dapat diseduh dan air seduhannya dapat digunakan untuk membilas mata,
sakit perut, dan mencuci luka.
Ø Contoh Pemakaian di
Masyarakat :
v Sakit
telinga tengah akibat radang
Cuci herba
bandotan segar secukupnya, lalu tumbuk sampai halus. Hasilnya, peras dan
saring. Gunakan air perasan yang terkumpul untuk obat tetes telinga. Sehari 4
kali, setiap kali pengobatan sebanyak 2 tetes.
v Luka
berdarah, bisul, eksim
Cuci herba
bandotan segar secukupnya sampai bersih, lalu tumbuk sampai halus. Turapkan
ramuan ke bagian tubuh yang sakit, lalu balut dengan perban. Dalam sehari,
ganti balutan 3-4 kali. Lakukan pengobatan ini sampai sembuh.
v Bisul,
borok
Cuci satu
tumbuhan herba bandotan segar sampai bersih. Tambahkan sekepal nasi basi dan
seujung sendok teh garam, lalu giling sampai halus. Turapkan ke tempat yang
sakit, lalu balut dengan perban.
v Reumatik,
bengkak karena keseleo
Sediakan satu
genggam daun dan batang muda tumbuhan bandotan segar, satu kepal nasi basi, dan
1/2 sendok teh garam. Selanjutnya, cuci daun dan batang muda sampai bersih,
lalu tumbuk bersama nasi dan garam. Setelah menjadi adonan seperti bubur
kental, turapkan ramuan ke bagian sendi yang bengkak sambil dibalut. Biarkan
selama 1-2 jam, lalu balutan dilepaskan. Lakukan perawatan seperti ini 2-3 kali
sehari.
v Perdarahan
rahim, sariawan, bisul, bengkak karena memar
Rebus 10-15 g
herba bandotan dalam dua gelas air bersih sampai tersisa menjadi satu gelas.
Setelah dingin, saring dan air saringannya diminum sekaligus. Lakukan 2-3 kali
sehari.
v Tumor
rahim
Rebus 30-60 g
herba bandotan kering segar atau 15-30 g herba kering dalam tiga gelas air
sampai tersisa menjadi satu gelas. Selain direbus, herba segar dapat juga
ditumbuk. Air rebusan atau air perasannya diminum satu gelas sehari.
v Sakit
tenggorokan
1.
Cuci 30-60 g daun bandotan segar sampai bersih, lalu tumbuk sampai halus.
Selanjutnya, peras dan saring. Tambahkan larutan gula batu ke dalam air perasan
secukupnya dan aduk sampai rata. Minum ramuan dan lakukan tiga kali sehari.
2. Cuci daun bandotan secukupnya, lalu
jemur sampai kering. Selanjutnya, giling sampai menjadi serbuk. Tiupkan serbuk
ke dalam tenggorokan penderita.
v Malaria,
influenza
Rebus 15-30 g
herba bandotan kering dalam dua gelas air sampai tersisa menjadi satu gelas.
Setelah dingin, saring dan minum sekaligus. Lakukan dua kali sehari.
v Perut
kembung, mulas, muntah
Cuci satu buah
tumbuhan bandotan ukuran sedang sampai bersih, lalu potong-potong seperlunya.
Rebus dalam tiga gelas air sampai tersisa menjadi satu gelas. Setelah dingin,
saring dan minum sekaligus. Lakukan pengobatan ini 2-3 kali sehari sampai
sembuh.
v Perawatan
rambut
Cuci, daun dan
batang bandotan segar sampai bersih, lalu tumbuk sampai halus. Oleskan hasil
tumbukan ke seluruh kulit kepala dan rambut. Tutup kepala dengan sepotong kain.
Biarkan selama 2-3 jam. Selanjutnya, bilas rambut. (4)(31)
Ø
Toksisitas
Tanaman ini sangat toksik terhadap embrio pada trimester pertama.(2-3)
Curcuma zedoaria Rosc.
Curcumae zedoariae Rhizoma(Rimpang Kunir Putih) (Badan pengawas obat dan makanan RI.
2010)
Jenis: Curcuma
zedoaria (Christm.) Roscoe(Badan pengawas obat dan makanan RI. 2010)
Curcumae zedoariae Rhizoma adalah rimpang Curcuma zedoaria (Christm.)Roscoe,
anggota suku Zingiberaceae.(Badan pengawas obat dan makanan RI. 2010)
Sinonim
C. zedoaria (Berg.) Roscoe, C. zerumbet Roxb.,C.pallida
Lour., Amomum zedoaria Christm., A. zerumbet J.Konig.(Badan pengawas obat
dan makanan RI. 2010)
Nama Daerah
Jawa: Kunir putih, temu putih (Jakarta), koneng tega
(Sunda).(Badan
pengawas obat dan makanan RI. 2010)
Nama Asing
Inggris: Zedoary; Thailand: Khamin khun, khamin oi; Perancis:
Zedoaire; India: Shati.(Badan pengawas obat dan makanan RI. 2010)
Tanaman
kunir putih Simplisia kering
rimpang kunir putih
Deskripsi Tanaman :
Tumbuhan berhabitus terna setahun,
tinggi dapat mencapai 2 m, batang semu berwarna hijau atau coklat tua, batang
sejati berupa rimpang berkembang sempurna di dalam tanah, beruas-ruas,
bercabang-cabang kuat, berwarna coklat muda sampai coklat gelap, bagian dalam
berwarna kuning, jingga dan ada sedikit warna biru kehijauan, berbau aromatik
begitu pula pada umbinya. Setiap batang semu tersusun atas 2-9 helai daun yang
berbentuk lonjong sampai lanset, berwarna hijau atau coklat keunguan terang
sampai gelap, panjang 31-84 cm, lebar 10-18 cm, panjang tangkai daun (termasuk
helaian) 43-80 cm. (Badan
pengawas obat dan makanan RI. 2010)
Perbungaan berupa bunga majemuk
bulir, ibu tangkai bunga muncul dari antara 2 ruas rimpang (lateralis), bulat
memanjang, panjang 9-23 cm, lebar 4-6 cm, tangkai ramping, berambut, panjang
10-37 cm,sisik berbentuk garis, berambut halus, panjang 4-12 cm, lebar 2-3 cm;
berdaun pelindung banyak, panjangnya melebihi atau sebanding dengan mahkota
bunga, berbentuk bulat telur sungsang (terbalik) sampai lonjong, berwarna
merah, ungu atau putih dengan sebagian dari ujungnya berwarna ungu, bagian
bawah berwarna hijau muda atau keputihan, panjang 3-8 cm, lebar 1,5-3,5 cm.(Badan pengawas obat
dan makanan RI. 2010)
Kelopak bunga berwarna putih berambut, panjang
kelopak 8-13 mm. Mahkota bunga berbentuk tabung dengan panjang keseluruhan 4,5
cm, tabung berwarna putih atau kekuningan, panjang 2-2,5 cm, helaian mahkota
berbentuk bulat telur atau lonjong, berwarna putih dengan ujung berwarna merah
atau merah tua, panjang 1,25-2 cm, lebar 1 cm. Benang sari 6, 5 benang sari
menjadi lembaran menyerupai bibir yang berbentuk bulat atau bulat telur
sungsang (terbalik), berwarna jingga dan kadang-kadang pada tepinya berwarna
merah, panjang 14-18 cm, lebar 14-20 mm, benang sari fertil berwama kuning
muda, panjang 12-16 mm, lebar 10-15 mm, panjang tangkai sari 3-4,5 mm, lebar
2,54,5 mm, kepala sari berwarna putih, panjang 6 mm, tangkai putik panjang 3-7
mm. Buah berambut, panjang 2 cm. (Badan pengawas obat dan makanan RI. 2010)
Simplisia:
Berupa irisan
melintang berbentuk bulat, berkerut, tepi tidak rata, permukaan kasar, tebal
2-4 mm, berwarna, kuning kecoklatan, berserat, jika dipatahkan meninggalkan
bekas patahan teratur. Bau khas, aromatik, rasa agak pahit.(Badan pengawas obat
dan makanan RI. 2010)
Habitat
Tumbuh baik di daerah
tropis mulai dari dataran rendah sampai 750 m dpl.Dibudidayakan sebagai tanaman
obat di Pulau Jawa, di bawah naungan atau tumpang sari dengan tanaman pisang
ataupun tegakan pohon jati.(Badan pengawas obat dan makanan RI. 2010)
Kandungan Kimia
Minyak atsiri:
Zingiberen, 1,8 sineol, D-kampora, D-kampen, Dborneol, α-pinen, kurkumol,
zederon, kurkumeneol, kurkulon, furanodienon, isofuranodienon. Kurkuminoid:
Kurkumin, dismetoksikurkumin, bisdesmetoksikurkumin. Ekstrak etanol mengandung
asam parametoksi sinamat etil ester.(Badan pengawas obat dan makanan RI. 2010) .
Efek Farmakologi
Telah diteliti efek
antiradang minyak atsiri temu putih terhadap udem buatan pada tikus putih
betina galur Wistar. Tikus diinduksi dengan karagenan, 30 menit setelah
pemberian oral minyak atsiri berbagai dosis dari 450-800 mg/kgBB dan pembanding
kurkumin 30 mg/kgBB. Hasil percobaan menunjukkan bahwa efek antiradang minyak
atsiri dosis 800 mg/kgBB setara dengan kurkumin dosis 30 mg/kgBB.Minyak atsiri
rimpang kunir putih dapat menghambat pembentukan radang pada tikus putih galur
Wistar dengan dosis 800 mg/kg BB.Kurkumin yang terkandung dalam rimpang temu
putih terbukti memiliki efek antiradang, baik secara akut maupun kronis pada
model hewan percobaan dan memiliki potensi yang hampir sama dengan fenilbutason
dan kortison.(Badan
pengawas obat dan makanan RI. 2010)
Indikasi
Membantu mengurangi
bengkak dan proteksi hati.(Badan pengawas obat dan makanan RI. 2010)
Kontraindikasi
Tidak boleh digunakan
untuk ibu hamil.(Badan
pengawas obat dan makanan RI. 2010)
Peringatan
Hati-hati penggunaan
pada ibu menyusui.(Badan
pengawas obat dan makanan RI. 2010)
Efek yang Tidak Diinginkan
Kemungkinan terjadi
reaksi alergi.(Badan
pengawas obat dan makanan RI. 2010)
Interaksi Obat
Belum pernah dilaporkan.(Badan pengawas obat
dan makanan RI. 2010)
Toksisitas
LD50 serbuk rimpang kunir
putih sampai dengan dosis 2375 mg/kg BB tikus yang diberikan secara p.o masih
aman.(Badan
pengawas obat dan makanan RI. 2010)
Penyiapan dan Dosis
Sebanyak 1-1,5 g serbuk kunir putih dimasukkan
ke dalam air dingin, diaduk 3-5 menit, digunakan 1 cangkir/hari.(Badan pengawas obat
dan makanan RI. 2010)
Penyimpanan
Simpan di tempat sejuk dan kering,
di dalam wadah tertutup rapat, jauh dari jangkauan anak-anak.(Badan pengawas obat
dan makanan RI. 2010)
Terapi Herbal Curcuma longa L (http://www.
tmionline.org/ ‘Turmeric: What’s in an Herb Name’. 25/02/09)
Klasifikasi :
Kingdom :
Plantarum
Divisi :
Spermatophyta
Sub-divisi :
Angiospermae
Kelas : Monocotyledoneae
Ordo
: Zingiberales
Famili :
Zingiberaceae
Genus :
Curcuma
Species :
Curcuma longa L
- Deskripsi :
Tanaman semak, tinggi lebih kurang 70 cm.
Batang semu, tegak, bulat, membentuk rimpang, warna hijau kekuningan. Daun
tunggal, bentuk lanset memanjang, ujung dan pangkal runcing, tepi rata, panjang
20-40 cm, lebar 8-12,5 cm, pertulangan menyirip, warna hijau pucat. Bunga
majemuk, berambut, bersisik, panjang mahkota lebih kurang 3 cm, lebar 1,5 cm,
warna kuning.
(http://www.idionline.org/_05_infodk_obattrad9.htm.
24/03/07)
Bukti ethnobotanical menunjukkan bahwa kunir
telah berada di india sejak lama, ini diyakini bahwa kunir digunakan
disepanjang wilayah penyebaran agama Hindu yang membentang dari India ke asia jauh.
Penyebaran kunir ke Cina pada tahun 700 M (Ridley, 1912). Burkill (1966)
percaya bahwa penyebarannya sampai ke Afrika barat pada abad ke-13 dan ke timur
Afrika di abad ke-17 masing-masing. ini diperkenalkan ke jamaica di 1783
(velayudhan et al.1999). Sekarang Kunir tumbuh di India, Pakistan, Malaysia,
Myanmar, Vietnam, Thailand, Pilipina, Jepang, Cina, Korea, Rri Lanka, Nepal,
pulau-pulau di pasifik selatan, Afrika timur dan barat, Malagasi, Caribbean
pulau, dan Amerika tengah, sekarang India merupakan utama penghasil dan
pengekspor kunir. Genus curcuma termasuk kepada keluarga zingiberaceae dan
berisi 49 jenis dan 1400 spesies. Sebagai tambahan terhadap Curcuma longa, C.
zedoaria rosc. dan C. xanthorrhiza roxb. juga merupakan sumber dari sebagian kecil
pewarna curcumin.
Velayudhan et al. (1999) mengakui enam taxonomic
jenis dalam C. longa berdasarkan di kwantitatip taxonomic analisis, yaitu C.
longa var. typica, C. longa var. atypica, C. longa var. camphora, C. longa var.
spiralifolia, C. longa var.
musacifolia dan C. longa var. platifolia.
kebanyakan dari C. longa yang ditemukan di india berasal dari C. longa var.
typica atau atypica. (Peter.K.V. 2001. Handbook of Herbs and Spices. Vol 1.
Chapter 26. Woodhead Publishing Limited, Cambridge, England.)
- Kandungan Kimia (Struktur) : Curcumin.
Demetoxycurcumin,
Bisdemetoxycurcumin (ESCOP, 2000, 107)
(Brazilian Journal of Chemical Engineering
www.scielo.br. 14/02/09)
- Biosintesis (Skema Pokok)
- Dosis dan Metode Pemberian :
Dewasa : 1,5 – 3 g
serbuk rimpang setiap hari dengan pemberian oral. (ESCOP)
- Mekanisme Kerja Sebagai Antiinflamsi :
Curcumin menghambat seminal siklooksigenase dari
darah domba dengan IC50 8,8μM yang dibandingkan dengan 1,2 μM indometacin. Pada
penelitian yang lain juga menghambat 5-lipooksigenase pada netrofilis
peritonial tikus (IC50 30 μM yang dibandingkan dengan 0,5 μM asam
nordihydroguaiaretik) dan siklooksigenasepada platelet manusia (IC50 2 μM). Curcumin juga menghambat agregasi
platelet yang diinduksi oleh arakidonat, adrenalin dan kolagen.(ESCOP)
- Aktivitas Lainnya :
Digunakan pada pengobatan gangguan pencernaan ringan
dan kelainan pada sistem kandung empedu. (ESCOP)
Efek Farmakologi
Aktivitas farmakologi
Beberapa penelitian secara in vitro dan in vivo
menunjukkan, kunyit memunyai aktivitas sebagai antiinflamasi (antiperadangan),
aktivitas terhadap peptic ulcer, antitoksik, antihiperlipidemia, dan aktivitas
antikanker.
Obat yang diberikan secara intraperitoneal pada
tikus efektif untuk mengurangi inflamasi (peradangan) akut dan kronik.
Efektivitas obat terhadap tikus yang dilaporkan sama dengan hidrokortison
asetat atau indometasin untuk anti-inflamasi. Jus kunyit atau serbuk yang
diberikan secara oral tidak menghasilkan efek antiinflamasi, hanya injeksi
intraperitoneal yang efektif.
Dari percobaan yang telah dilakukan diperoleh hasil,
kurkumin hanya dapat dideteksi pada feces, namun tidak pada sel darah, plasma
atau urine. Hal ini disebabkan kurkumin memunyai ketersediaan hayati yang
rendah dan kurkumin merupakan senyawa yang sangat lipofil.
Minyak atsiri dari rimpang kunyit menunjukkan
aktivitas antiinflamasi pada tikus yang menekan arthritis, udem tangan/kaki
yang diinduksi dengan karagenan dan inflamasi yang diinduksi dengan hialuronidase.
Aktivitas antiinflamasi, tampaknya melalui penghambatan enzim tripsin dan
hialuronidase. Kurkumin dan turunannya yaitu natrium-kurkuminat yang diberikan
secara intraperitoneal (ke organ dalam perut) dan oral menunjukkan aktivitas
antiinflamasi yang kuat yaitu dengan menekan udem yang diinduksi dengan
karagenan pada tikus.
Ekstrak obat dalam metanol atau air yang diberikan
secara oral pada kelinci, secara signifikan menurunkan sekresi gastrik dan
meningkatkan kandungan musin pada gastrik. Ekstrak obat dalam etanol yang
diberikan intragastrik pada tikus sangat efektif untuk menginhibisi sekresi
gastrik dan melindungi mukosa gastroduodenal yang disebabkan luka akibat stres
hipotermik.
Ekstrak kurkumin dapat mencegah kerusakan hati yang
diinduksi alkohol pada tikus yang mekanisme kerjanya melalui inhibisi gen
NF-kB. Kurkumin memblok endotoksin yang merupakan hasil dari aktivasi NF-kB dan
menekan cytokin, chemokin, Cyclooxygenase-2 (COX-2), dan inducible Nitrit
Oxydase Sinthetase (iNOS), sehingga mencegah kerusakan hati.
Ekstrak kurkuma juga dapat mencegah hepatotoksisitas
yang diinduksi senyawa kimia CCl4 (karbontetraklorida) dengan mekanisme
berikatan dengan protein dan reseptor pada permukaan membran sel menggantikan
senyawa toksik dan mencegah kerusakan sel.
Ekstrak kurkuma dapat menurunkan semua komposisi
lipid (trigliserida, pospolipid dan kolesterol) pada aorta, dan kadar
trigliserida pada serum secara ex vivo. Kurkumin dapat menghambat agregasi
platelet (PAF) yang distimulasi mediator endogen seperti faktor agregasi
platelet dan asam arakhidonat melalui penghambatan produksi tromboxan (TXA2)
dan memblok pelepasan second messenger Ca2+.
Kunyit dapat mencegah kanker usus dengan cara
menginhibisi enzim-enzim lipid peroksidase dan siklooksigenase-2 yang merupakan
implikasi perkembangan kanker dan menginduksi enzim glutation S-transferase.
Induksi siklooksigenase-2 dihubungkan dengan produksi prostaglandin (hormon
pengatur gerakan otot). Kunyit juga menunjukkan aktivitas sebagai antioksidan
yang dihubungkan dengan mekanisme pemadaman singlet O2 yang dapat merusak DNA,
namun sifat antioksidan ini bukan sebagai penghambatan superoksida anion atau
radikal bebas hidroxil.
Serbuk kunyit yang diberikan secara oral pada 116
pasien dengan kondisi dispepsia, flatulen, dan asam lambung menunjukkan respon
yang membaik secara signifikan dibanding kelompok kontrol. Pasien menerima 500
mg serbuk obat empat kali sehari selama tujuh hari, uji klinik yang diukur
adalah efek obat pada tukak peptik yang menunjukkan, rimpang kunyit
meningkatkan penyembuhan tukak dan menurunkan sakit pada bagian perut.
Uji klinik kedua yang diukur adalah menunjukkan,
kurkumin efektif sebagai antiinflamasi. Dalam waktu dua minggu, dilakukan
pengujian secara acak pada 18 pasien dengan penyakit reumathoid arthritis yang
terbagi dalam tiga kelompok pemberian yang berbeda yaitu diberikan kurkumin
(1200 mg/hari), fenilbutazon (30 mg/hari), dan kelompok kontrol. Hasil yang
didapat yaitu kelompok yang diberi kurkumin dan fenilbutazon menunjukkan respon
antiinflamasi jauh lebih baik daripada kelompok kontrol.
Tingkat keamanan Studi keamanan (uji toksisitas)
terhadap rimpang kunyit menunjukkan, ekstrak kunyit aman digunakan dalam dosis
terapi. Rimpang kunyit yang diberikan secara oral tidak memberikan efek
teratogenik (dampak pada embrio/janin) pada tikus. Keamanan ekstrak kunyit
selama kehamilan belum terbukti, penggunaan selama kehamilan harus di bawah
pengawasan medis. Ekskresi ekstrak kunyit melalui ASI dan efeknya pada bayi
belum terbukti, sebaiknya penggunaan selama menyusui di bawah pengawasan medis.
Dari uji toksisitas yang telah dilakukan selama 90
hari untuk konsumsi kunyit diperoleh hasil bahwa efek toksik terjadi pada 50
kali dosis yang biasa digunakan manusia setiap harinya.
10. Pustaka
2.
Direktorat
Obat Asli Indonesia, 2007, Acuan
SediaanHerbal, Volume Ketiga, Edisi pertama, Badan Pengawas Obat
dan Makanan Republik Indonesia, Jakarta,
46 – 49.
3.
Direktorat
Obat Asli Indonesia, 2008, Acuan
SediaanHerbal,
Volume Keempat, Edisi pertama, Badan Pengawas Obat dan Makanan Republik
Indonesia, Jakarta, 94– 97.
5. Hisran, Dr. N.C. Soegiarso dan Dr. M. B.
Wattimena, 1988, Daun Bandotan (Ageratum conyzoides Linn.) dan Rimpang
Temu Kunci (Kaempferia pandurata
Roxb.) Pada Tikus Putih Galur Wistar, Skripsi, Institut Teknologi Bandung,
33-36.
6. Sukandar. E.Y., Dr et al., 1998, Pembuatan
Sediaan Fitofarmaka Antiinflamasi Yang Efektif dan Aman, Laporan Akhir
Penelitian Hibah Bersaing VI Tahun I Perguruan Tinggi, Direktorat Jendral
Pendidikan Tinggi, 9-10.
7. Hanni
Prihhastuti Puspitasari, Sukardiman, Aty Widyawaruyanti, 2003, Uji Aktivitas Sitotoksik Ekstrak Metanol
Herba Ageratum conyzoides L. Pada Kultur Sel Mieloma Mencit, Majalah
Farmasi Airlangga, Vol.3 No.3,:93
8. Sukardiman,
Hadi P. dan Aty W., 2000, Penapisan
Antikanker Tanaman Obat Indonesia dengan Molekul Target Enzim DNA Topoisomerase,Penelitian.
FFUA, Surabaya
9. Taufan H. Sugara. 2010. Karakterisasi
Senyawa Aktif Antibakteri dari Fraksi Etil Asetat Daun Tanaman Bandotan (Ageratum
conyzoides L.). Institut Pertanian Bogor.
10. Mega Yudistira, 2006.Efektivitas Daun Bandotan (Ageratum
conyzoidesLinn.) Sebagai Larvisida Nyamuk Culex. Universitas Maranatha.
11. Dwita Nur Anggraini, 2010. Pengaruh
Pemberian Konsentrasi Filtrat Daun Bandotan (Ageratum conyzoides L.) Terhadap Mortalitas Ulat Kapas (Helicoverpa
armigera H.) secara In Vitro. Universitas Muhammadiyah Malang.
12. Mohd. Zaini A dan J. R. Wattimena, 1975.
Antipiretik Ageratum conyzoides,
Jasminum sambac dan Caesalpinia pulcherrima. Penelitian
Obah Bahan Alam Sekolah Farmasi ITB
13.
Gunawan
P. W., Elin Yulinah S., Iwang Soediro. 1999. Uji Antiinfeksi pada Punggung Kelinci dan Telaah Fitokimia Ekstrak Etil
Asetat dan Etanol Daun Ketimun dan Babadotan. Penelitian Obah Bahan
Alam Sekolah Farmasi ITB.
18. Ukwe Chinwe V, Ekwunife Obinna I, Epueke Ebele A,
Ubaka Chukwuemeka M. Antimalarial
activity of Ageratum conyzoidesin combination with chloroquine and artesunate. Asian Pacific Journal of Tropical Medicine
2010, Pages 943-947.
25. R.
Perumal Samy, S. Ignacimuthu, D.Patric Raja. Preliminary screening of
ethnomedicinal plants from India. Journal
of Ethnopharmacology, Volume
66, Issue 2, August 1999,
Pages 235-240.
26. Tote MV, Mahire NB, Jain AP, Bose S, Undale VR,
Bhosale AV. Effect of Ageratum conyzoidesLinn. on clonidine and haloperidolinduced catalepsy in mice.Pharmacologyonline 2009; 2: 186-194.
29. F.A.
Hamill, S. Apio, N.K. Mubiru, M. Mosango, R. Bukenya-Ziraba, O.W. Maganyi, D.D.
Soejarto. Traditional herbal
drugs of southern Uganda, I.
Journal of Ethnopharmacology, Volume 70, Issue 3, 15 July 2000, Pages 281-300
30. F.A
Hamill, S Apio, N.K Mubiru, R Bukenya-Ziraba, M Mosango, O.W Maganyi, D.D
Soejarto. Traditional herbal drugs of Southern Uganda, II: literature
analysis and antimicrobial assays. Journal
of Ethnopharmacology, Volume
84, Issue 1, January 2003,
Pages 57-78.